新醫療科技|美企研「基因書寫」治病 稱高效價廉
原文刊於信報財經新聞「EJ Tech 創科鬥室」
CRISPR-Cas9基因編輯技術自2012年發表以來,為不少飽受遺傳病、頑疾困擾的患者帶來新希望,惟這項技術存在一定局限,促成「基因書寫」技術漸受全球關注。美國生物科技初創Full Circles Therapeutics聯合創始人及CEO吳昊受訪時稱,他們首創的非病毒、高精度基因書寫技術,效率較傳統基因編輯技術提高至少500倍,不但大幅增加安全性,更聲稱生產成本可降低八成以上。

非病毒技術 避免疫反應
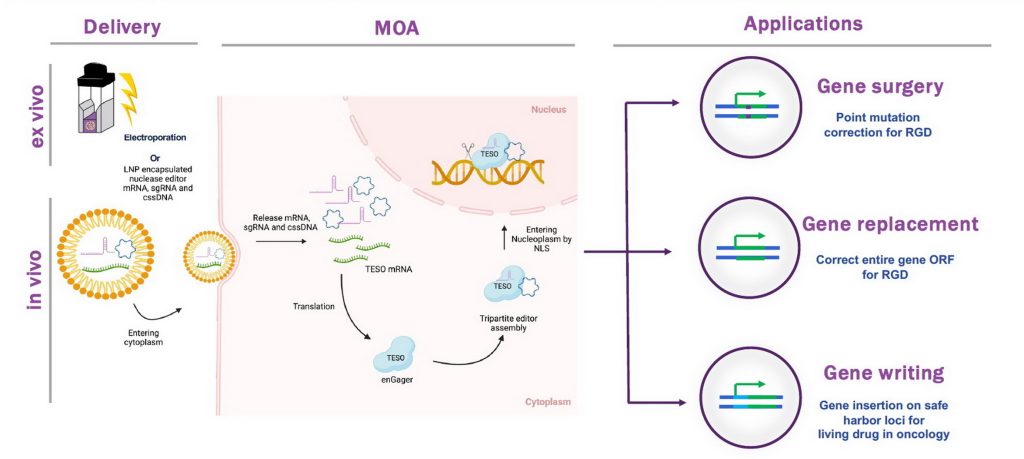
傳統的基因和細胞治療技術發展至今經過多次迭代,比如2007年獲得諾貝爾醫學獎的同源重組技術(Homologous Recombination),還有2012年面世、後來廣泛應用於腫瘤治療領域的CRISPR-Cas9技術,2016年的鹼基編輯技術,以及2019年的多樣化編輯技術等。吳昊表示,他們利用首創的GATALYST基因組整合平台,能夠實現非病毒、高精度基因組定點整合,可用於大片段DNA(脫氧核糖核酸)基因組插入、缺失和修復。
GATALYST採用原理仍是同源重組,惟選用單鏈環形DNA。吳昊提到,目前的基因細胞治療技術以病毒類治療手段主導,這意味引入外源DNA片段或編輯工具時,容易被人體免疫系統識別為外來物質,產生引發免疫反應,包括炎症、抗體等,會影響基因編輯效率及安全性。同時,若病人體內某些器官曾接觸病毒,或無法對此治療方法產生積極反應,更有患者因此死亡。
細胞基因治療費用十分昂貴,吳昊以獲得美國食品及藥物管理局(FDA)認證的6款CAR-T藥物為例,每針價格大約50萬美元(約390萬港元)。他解釋,這跟過去主要以病毒作為基因編輯原料有關,病毒生產佔整體成本六成。公司技術以單鏈環形DNA分子為非病毒供體模板,不僅能把同源重組的效率提高至少500倍,同時因其非病毒特性,所以更安全。
料惠及血友病患失聰者
吳昊指出,單鏈環形DNA使用非病毒載體系統,其生產工藝更簡單,更易控制質量及大規模生產,讓更多病人受惠。新技術未來有望治療更多頑疾,例如血友病A型、遺傳性失聰等,預計可惠及全球200萬名病人。目前技術未進入臨床試驗階段,吳昊稱最快在2025年向FDA申報臨床許可。
採訪、撰文:解青羽
支持EJ Tech

 如欲投稿、報料,發布新聞稿或採訪通知,按這裏聯絡我們。
如欲投稿、報料,發布新聞稿或採訪通知,按這裏聯絡我們。